分子遺伝学・分子生物学の臨床医学への応用により、疾患の発症・進展に関与する分子が多数同定されています。さらに、それらの疾患関連分子の生理的役割・機能の分子レベルでの理解に基づく新しい治療法が世界中で開発されています。当教室では大腸癌発症の鍵となるKRAS遺伝子の解析に始まり、KRASにより制御される分子であるepiregulinとKRAPの同定と機能解析など、これまでにさまざまな発癌関連分子の解析を行ってきました。
近年では、疾患ゲノム解析により自己免疫性甲状腺疾患の感受性遺伝子として、独自にZFATを同定・報告し、その機能解析を精力的に進めています。また、二次元環境とは異なる、より生体環境に近い三次元細胞培養系を樹立し、三次元特異的なKRAS制御シグナルの解析、および阻害剤の開発を行っています。
<RESEARCH SUMMARY/研究概要>
分子細胞生物学的解析、タンパク質・タンパク質相互作用解析、タンパク質・DNA相互作用解析、網羅的遺伝子発現解析を中心とした分子間ネットワーク解析と遺伝子改変マウス等を利用したin vivo・ex vivo解析を主たる解析手段とし、以下のZFAT、KRASに関する二つの研究課題を中心に研究を展開しています。
(1) ZFAT (Zinc-Finger Protein with AT-hook)が制御する細胞生命プログラムの分子メカニズムの解明
ZFATは18個のZinc-Fingerドメインと1つのAT-hookモチーフを持ち、核に局在するDNA結合タンパク質です。ZFATの発現は脊椎動物に限定され、そのアミノ酸配列は魚からヒトまで、非常に高度に保存されています。
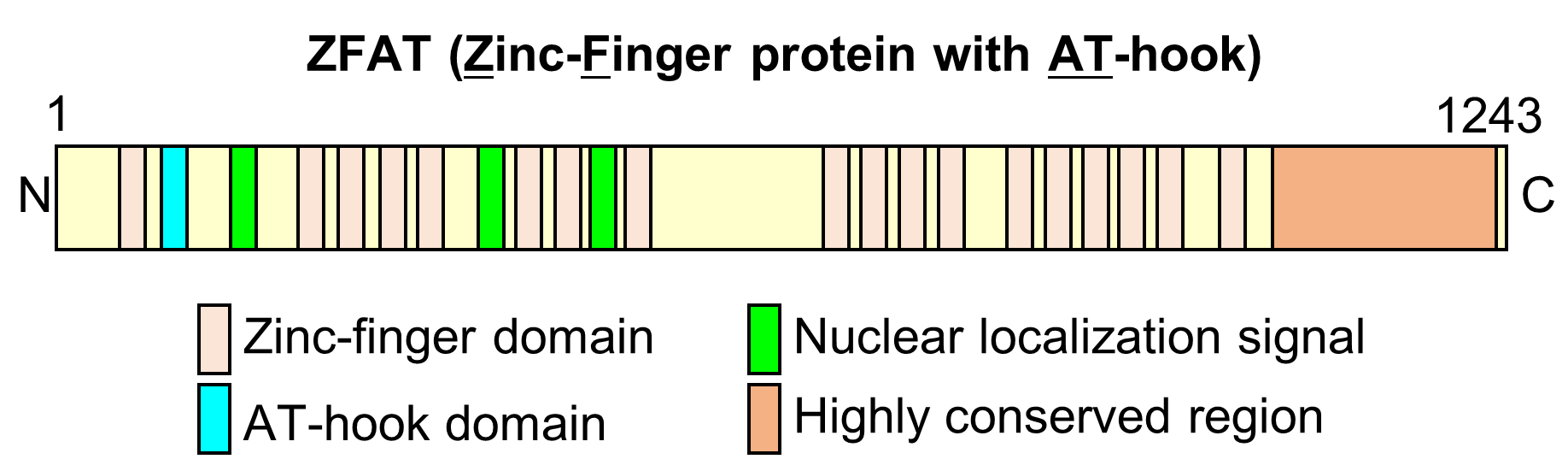
これまでに私たちは、様々なZFAT遺伝子改変マウスを作成・解析するとともに、ZFATの細胞生物学的な解析を行い、以下のZFATの機能と重要性を明らかにしてきました。
(1)ZFATは胎児の初期発生に必須であり、卵黄嚢造血過程において重要な役割を果たす。
(2)ZFATはT細胞の胸腺内分化、および末梢における恒常性維持に必須の因子である。
(3)ZFATは生後の骨髄における赤血球分化に関与する。
(4)末梢T細胞における転写因子FoxO1発現レベルの制御にZFATが重要な役割を果たす。
(5)ZFATは特定の遺伝子のプロモーター領域に結合し、そのmRNA転写を制御する。
最近私たちは、「ZFATがセントロメアに結合する」ことを見出しました。

セントロメアは染色体の均等分配に必須の染色体領域です。セントロメアからノンコーディングRNAが転写され、セントロメアの形成や機能制御に重要な役割を果たすことが知られていましたが、その転写制御メカニズムは全く分かっていませんでした。
私たちは、以下に示す「セントロメアノンコーディングRNA転写のZFATによる制御メカニズム」を明らかにしました。
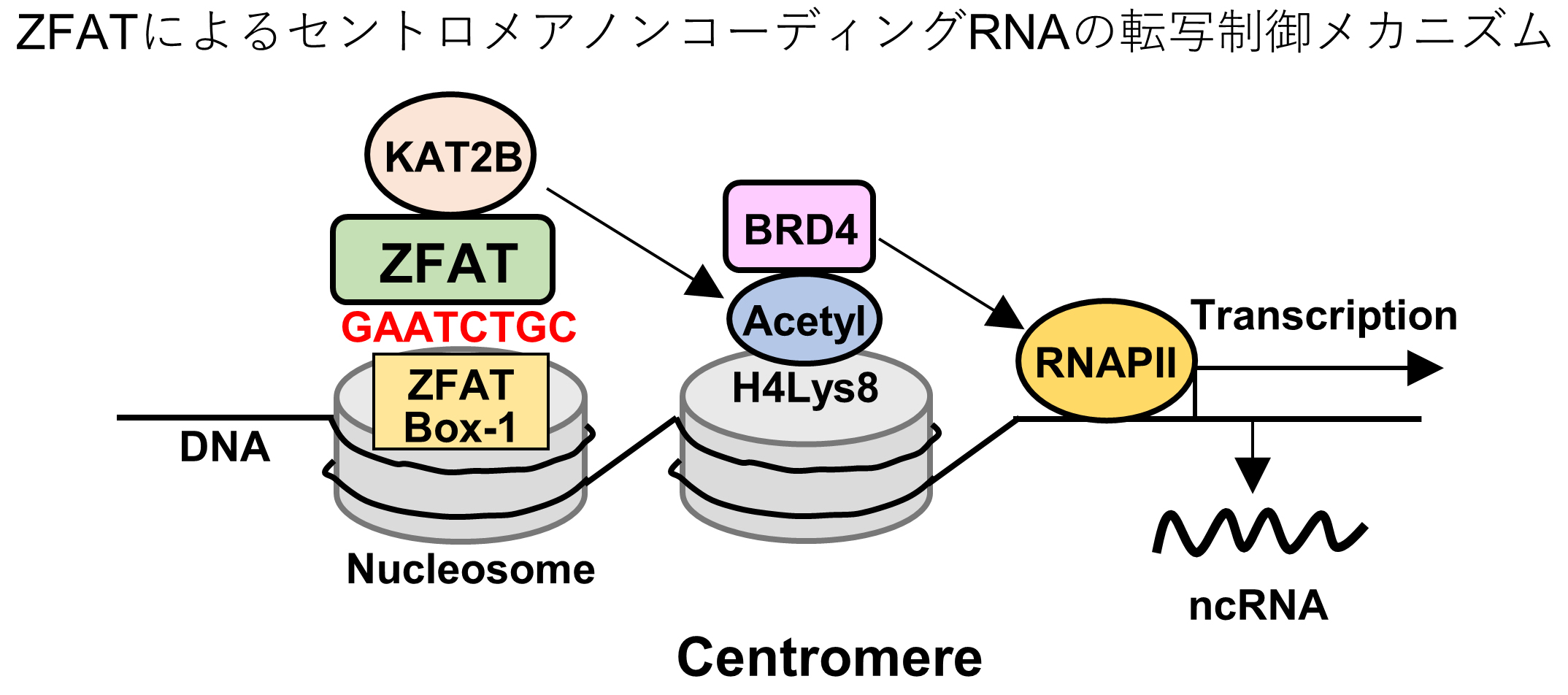
(1)ZFATは、セントロメアに存在する私たちがZFAT Box-1と名付けたDNA配列に結合し、ヒストンアセチル化酵素であるKAT2Bをセントロメアにリクルートする。
(2)ZFATによってリクルートされたKAT2Bは、セントロメア領域のヒストンH4のリジン8をアセチル化(H4K8ac)する。
(3)KAT2Bによって修飾されたH4K8acに、ブロモドメインタンパク質であるBRD4が結合し、BRD4がRNAポリメラーゼIIを活性化させることにより、ノンコーディングRNAの転写が活性化される。
これらの成果はNucleic Acids Research誌に掲載されました。
次いで、2021年に、
(4)ZFATのセントロメアへの局在には、セントロメアタンパク質CENP-Bが重要な役割を果たす。
ことを明らかにし、Journal of Biological Chemistry誌に報告しました。
さらに、2022年に、
(5)細胞死関連タンパク質DAXXによるセントロメアノンコーディングRNAの転写制御に、ZFATが重要な役割を担っている。
ことを明らかにし、Journal of Biological Chemistry誌に報告しました。
セントロメアにおけるノンコーディングRNA転写の異常が、細胞の癌化につながる染色体分配異常を引き起こすことが知られています。したがって、ZFAT遺伝子の変異・発現異常が染色体分配の異常を引き起こし、癌の発症・進展につながる可能性が考えられます。セントロメアノンコーディングRNA転写のZFATによる制御機構のさらなる解明を行い、新しい分子機序に基づく癌治療法・治療薬の開発のための分子基盤の構築を目指しています。
(2) KRAS分子が三次元環境特異的に制御する分子間ネットワークの解明
当該グループでは、癌における変異KRASに対する分子標的療法の可能性を世界に先駆けて報告し、その後もKRAS分子の機能に関して国際的な共同研究を多数実施し、重要な知見を発信し続けている。しかしながら、固形腫瘍において最も高頻度に存在する変異KRASそのものを標的とする分子標的薬はいまだ開発されておらず、さらに、臨床的に効果の高いEGFR阻害剤がKRAS変異を持つ癌には効果がないことが示された。そのような背景において、KRAS制御分子のin vivoにおける機能的解明とそれに基づく創薬標的の同定は臨床的視点からも重要な意義を持つ。独自に樹立した生体環境類似in vitro三次元培養システムを利用し、生体内におけるKRAS制御分子群の機能解明と分子間ネットワーク解析と、3次元環境における変異KRAS特異的なシグナル抑制化合物のスクリーニングを行い、KRASを起点とする腫瘍制御ネットワークの解明、および新規制癌剤の開発を行い、以て癌の先駆的治療法開発の基盤構築に資することを目的とする。
< 本年度の研究成果 >
2) KRASの生体内での機能の理解に基づいたKRAS制御シグナルの解明と阻害剤の探索
(2-A)KRAS分子が三次元環境特異的に制御するシグナルの阻害剤の探索
 変異KRASをゲノム編集にて欠失したHKe3細胞に野生型KRASを強制発現させたHKe3-wtKRASおよび、変異型KRASを強制発現させたHKe3-mtKRAS細胞を利用したin vitro浮遊培養系を構築した。このシステムを用いて、イギリス(グラスゴー大学)、およびロシア(ブロヒン癌センター)との国際共同研究により取得した新規PDE4阻害剤、さらには、理化学研究所より取得した天然物由来化合物コアライブラリーのスクリーニングを施行した。その結果、これまでに抗がん剤と考えられていない構造を有し、癌のみに作用し、正常組織には影響のないコア化合物と類似骨格を有する派生化合物をいくつか取得した(図1)。
変異KRASをゲノム編集にて欠失したHKe3細胞に野生型KRASを強制発現させたHKe3-wtKRASおよび、変異型KRASを強制発現させたHKe3-mtKRAS細胞を利用したin vitro浮遊培養系を構築した。このシステムを用いて、イギリス(グラスゴー大学)、およびロシア(ブロヒン癌センター)との国際共同研究により取得した新規PDE4阻害剤、さらには、理化学研究所より取得した天然物由来化合物コアライブラリーのスクリーニングを施行した。その結果、これまでに抗がん剤と考えられていない構造を有し、癌のみに作用し、正常組織には影響のないコア化合物と類似骨格を有する派生化合物をいくつか取得した(図1)。
(2-B)KRAS制御シグナルの解明
変異KRAS欠失細胞では、オートファジーに関連するATG3の発現が誘導されており、変異KRASがオートファジーを阻害することが悪性転化の一つの原因であることが示唆された。また、長鎖ノンコーディングRNAの一つであるANRIL、代謝関連分子KRAP、および細胞極性因子ALPK2などの変異KRASの下流の分子が細胞塊増殖、癌代謝や細胞塊凝集に関与することを示す結果が得られつつある。
