研究テーマ1
動脈硬化に起因する前立腺肥大症発症メカニズムの解明1
研究代表者:羽賀宣博
研究の概要
前立腺肥大症(BPH)は、その発症原因は明らかになっておらず、また、現治療においても効果が限定的であり解決しなければならない課題が多い。
近年、BPH とメタボリックシンドローム(Mets)との関連が示唆されている。
Metsは、内臓脂肪の蓄積を中心に、糖脂質代謝異常や高血圧をきたす代謝症候群であるが、体内に蓄積された脂肪の質(リポクオリティ)の低下により、飽和脂肪酸を放出し、臓器の機能不全をきたす。
前立腺は、周囲に豊富な脂肪組織が存在し、このリポクオリティの低下により、BPH が発症するのではないかという着想に至った。
この仮説を証明するために、動物モデルとヒト検体を用いて、肥満に伴う前立腺及び周囲組織内の脂肪細胞の形態的及び機能的な変化によるに前立腺腫大や骨盤内動脈硬化への影響を検討する。
さらに動物モデルを用いて、リポクオリティの低下を改善する薬剤による BPH への影響を明らかにし、創薬開発につなげる研究を行う。
1 : 本研究の学術的背景
脂肪毒性に伴う前立腺への影響
Mets に伴う中心性肥満が、前立腺腫大や下部尿路機能障害をきたすことが様々な疫学的研究で報告されているがその詳細なメカニズムに関しては、未だ明らかにはなっていない。
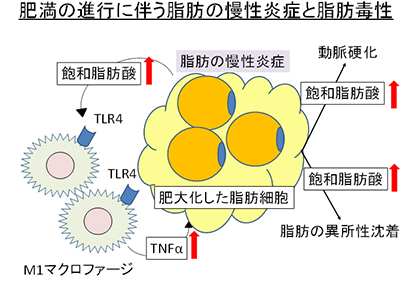
近年、脂肪組織内のマクロファージの機能に注目が集まっている。脂肪組織内にはM1とM2マクロファージが存在している。
M2マクロファージは抗炎症作用を担う一方で、M1マクロファージは、肥満の進行に伴い、炎症促進に働き脂肪組織に浸潤することで、脂肪組織の慢性炎症きたし、脂肪毒性をもたらす。
TNFαは、M1 マクロファージから放出し、肥大化した脂肪細胞から遊離脂肪酸、特に飽和脂肪酸を放出する。
飽和脂肪酸は、マクロファージに存在する Toll-like receptor(TLR)4 を活性化し脂肪細胞の慢性炎症のみならず、飽和脂肪酸を遊離し、血中を介して他臓器に作用し、脂肪毒性と称される臓器機能障害をきたす。
具体的には動脈硬化の促進や、骨格筋や肝臓に脂肪沈着を来すことでインスリン抵抗性をきたすことが明らかとなっている。
したがって、この脂肪毒性により、前立腺動脈の動脈硬化の進展ならびに、前立腺組織そのものが影響を受け、BPHが発症しているのではないかと考えた。
骨盤内動脈硬化に伴う前立腺肥大症の発生
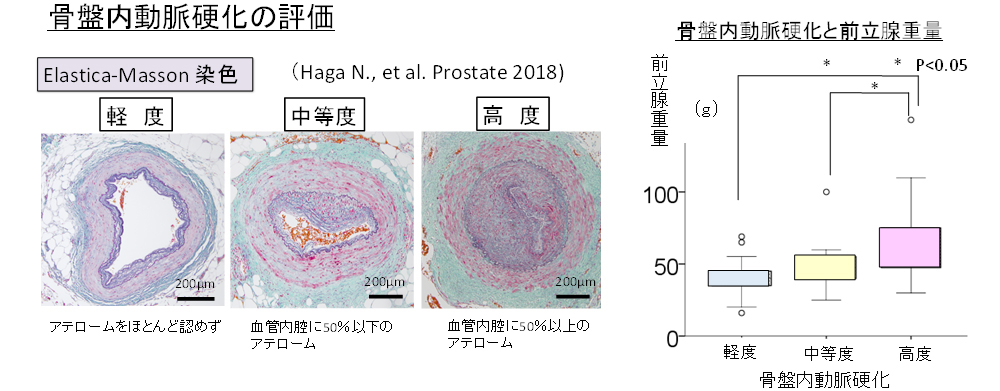
私達はロボット支援前立腺全摘術(RARP)施行時に前立腺の vascular pedicle (血管茎) の内部に存在する前立腺の動脈を摘出し、動脈硬化を評価した。
その結果、動脈硬化の進展に伴い、BPH をきたすことをヒト検体を用いて初めて証明した(Haga et al, Prostate 2018)。その原因として、前立腺臓器内部の酸化ストレスに伴う組織障害と前立腺細胞のリモデリングにより、BPHが発症していることを明らかにした。
さらに、骨盤内動脈硬化は、前立腺組織の慢性炎症を惹起していることを証明した(Haga et al, Prostate 2019)。
このように、骨盤内動脈硬化に伴う酸化ストレスや慢性炎症がBPHをきたすことを明らかにしたが、これまでの検討でBPHの発症要因がすべて明らかになったわけではない。
〈仮 説〉
肥満の進行に伴う脂肪の質(リポクオリティ)の低下により脂肪毒性が誘発され、前立腺周囲の微小環境ならびに前立腺組織の変調をきたすことが、BPH の発症要因となっているのではないかと仮説を立てた。
2 : 本研究の目的及び学術的独創性と創造性
本研究の目的
メタボリック症候群に伴う内臓脂肪の沈着により、BPHが発症することは疫学的研究により明らかになっているが、その要因として、リポクオリティの低下に伴う脂肪毒性に着目した。
本研究では、脂肪毒性に伴う前立腺、及び前立腺周囲の微小環境への影響を検討することにより、BPHの病因を明らかにし、創薬開発につなげることを目的とした。
リポクオリティの低下に伴うBPHの発症機序を解明し、それに即した治療法の開発は、これまでのBPH治療薬とは一線を画する。
本研究の学術的な独自性は、BPHの発症要因を、現在ほとんど明らかになっていないリポクオリティの低下に伴う前立腺への影響というユニークな視点から解明を試みている点であり、
創造性は、脂肪の炎症を抑制する薬剤の投与により、BPHの発症を抑制する先制治療の可能性を検討することである。
3 : 研究内容
ヒト検体を用いたリポクオリティの低下に伴うBPH発症機序の解明
レチウス腔の脂肪とヒト前立腺検体を用いて、リポクオリティの低下にともなう BPH の発症メカニズムを解明する。
具体的には、ヒト検体を用いて、内臓脂肪と前立腺組織内の脂肪の形態的及び機能的な変化に伴う前立腺重量や下部尿路症状への影響を検討する。
さらに、前立腺動脈の動脈硬化の程度や前立腺内部の細動脈の動脈硬化の影響を検討する。
4 : 本研究の方法
1)ヒト BPH発症過程における内臓脂肪と前立腺内脂肪による慢性炎症への関与
2020年度、レチウス腔の脂肪細胞と前立腺組織内の脂肪細胞数と脂肪細胞の長径を Image Pro を用いて計測する。
さらに、脂肪組織内の慢性炎症の指標となる Crown-like structure (CLS)もカウントする。
また、マクロファージの増加と局在の変化 (M2 < M1) を検討する。具体的には、Ibal1, CD80 と iNos で M1 の発現を、CD136 と Arginase1 発現で M2 の発現を、免疫染色および Western Blotting(WB)で測定する。
肥満に伴うレチウス腔と前立腺組織の脂肪細胞の形態的変化、慢性炎症の惹起を確認し、前立腺重量や下部尿路症状との関係を検討する。
2)ヒトBPH発症過程におけるMincleと炎症性サイトカインの発現機能解析
2021年度、M1マクロファージに発現するMincleは、肥満の脂肪組織において発現が増加し、脂肪蓄積能の減弱化をきたし、異所性の脂肪組織の沈着を促進する(2014 Nat Commun.) 。
内臓脂肪と前立腺組織内における Mincle および TLR4 の発現を、免疫染色、in-situ hybridization 等を用いて検討する。
さらに炎症性サイトカインである TNF-α や、前立腺間質細胞の分化増殖に関与する TGF-β1 及びFGFの測定を行う。
これらの測定結果と前立腺重量と下部尿路症状との関連を検討し、BPH 発症過程における脂肪毒性の影響を解明する。
3)ヒト BPH 発症過程における脂肪毒性による骨盤内及び前立腺内動脈の動脈硬化への影響
2022年度、動脈硬化の進展や異所性脂肪沈着の重要な因子である飽和脂肪酸の濃度を、血清、レチウス腔の脂肪、さらに前立腺組織内において測定し、飽和脂肪酸の骨盤内の動脈硬化と前立腺動脈の動脈硬化への影響を検討する。
さらに Mincle および TLR4 と動脈硬化との関連も検討し、脂肪毒性に伴う動脈硬化による BPH 発症のメカニズムを明らかにする。
5 : 研究結果の進捗
私たちは、ロボット支援前立腺全摘除術施行時に、これまでの術式では不可能であった、前立腺の vascular pedicle 内の前立腺動脈を単離し、骨盤内動脈の動脈硬化による BPH 発症メカニズムの解明に成功した。
さらに、現在、レチウス腔と前立腺内部の脂肪組織の形態的及び機能的な検討を行うべく、症例を蓄積している。
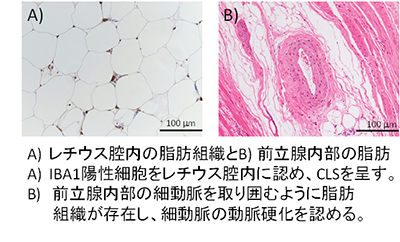
下の図に示すように、一定の割合でレチウス腔の脂肪に慢性炎症の指標である Crown-like structure (CLS)を認め(図A)、
さらに前立腺組織内にも脂肪の沈着及び、それに伴う前立腺内部の細動脈の動脈硬化が認められた(図B)。
関連する業績
1. Haga N, Akaihata H, Hata J, et al. The Prostate. 2019; 79(6):574-582.
2. Haga N, Akaihata H, Hata J, et al. The Prostate. 2018; 78(13):1001-1012
3. Haga N, Aikawa K, Shishido K, et al. Urology. 2009;73(1):200-4.
4. Haga N, Aikawa K, Shishido K, et al. Urologia Internationalis. 2011;87(2):230-7.
5. Haga N, Aikawa K, Ishibashi K, et al. International Journal of Urology. 2011;18(11):785-91.
6. Yazaki J, Haga N, Ishibashi K, et al. Neurourology and Urodynamics. 2011;30(3):461-7.
7. Nomiya M, Haga N, Kushida N, et al. Neurourology and Urodynamics. 2012;31(1):185-9.
8. Akaihata H, Haga N, Kojima Y, et al. The Journal of Urology. 2015;193(2):706-13.
9. Yabe M, Haga N, Ogawa S, et al. Neurourology and Urodynamics. 2016;35(8):920-5.
10. Takahashi N, Haga N, Ogawa S, et al. Lower Urinary Tract Symptoms. 2012;4(1):9-13.
11. Koguchi T, Haga N, et al. International Journal of Urology. 2019;26(2):234-240
12. Hata J, Haga N, Kojima Y, et al. International Journal of Urology. 2016;23(7):599-612.
13. Haga N, Aikawa K, Hoshi S, et al. PloS One. 2016;11(7):e0159514.
14. Haga N, Hata J, Matsuoka K, Neurourology and Urodynamics. 2018;37(1):322-30.
15. Haga N, Aikawa K, Hoshi S, et al. International Journal of Urology.. 2016;23(10):873-8.
16. Haga N, Takinami R, Tanji R, et al. Fukushima Journal of Medical Science. 2017;63(2):
17. Haga N, Kurita N, Yanagida T, et al. Surgical Endoscopy. 2018;32(1):145-53.
18. Haga N, Ogawa S, Yabe M, et al. Journal of Endourology. 2015;29(6):683-90.
19. Haga N, Ogawa S, Yabe M, et al. Urology. 2014;84(3):642-9.
20. Weimin Y, Haga N, Yanagida T, et al. Urology Journal. 2016;13(1):2519-26.
21. Haga N. Journal of Endourology. 2016;30(3):36
22. Onoda M, Haga N, et al Neurourology and Urodynamics.. 2019; 38(8):2200-220
